La fórmula de la tensión es una herramienta fundamental en la física y la ingeniería, y permite calcular la fuerza resultante que actúa sobre un objeto en función de su masa y aceleración. Esta fórmula, también conocida como la ley de Newton sobre la segunda ley del movimiento, es esencial para comprender cómo los objetos se mueven y reaccionan bajo diferentes condiciones y fuerzas aplicadas. En este artículo, exploraremos en profundidad la fórmula de la tensión, su historia, sus aplicaciones prácticas, y cómo se utiliza en diferentes campos de la física y la ingeniería.
- La fórmula de la tensión es la relación entre la fuerza aplicada sobre un objeto y la superficie de contacto entre ese objeto y la fuerza aplicada.
- La fórmula matemática de la tensión se expresa a través de la ecuación T=F/A, donde T es la tensión, F es la fuerza aplicada y A es la superficie de contacto donde se aplica la fuerza.
- La tensión se expresa en unidades de medida de fuerza por unidad de área, como N/m² (newtons por metro cuadrado) o Pa (pascals). La fórmula de la tensión es importante en muchos campos, como la ingeniería, la física y la mecánica.
Ventajas
- Permite obtener la cantidad de fuerza ejercida por un objeto en un circuito eléctrico, lo que proporciona información valiosa para su diseño y funcionamiento.
- Ayuda a prevenir fallas en un circuito eléctrico, ya que la tensión puede ser monitoreada para asegurar que se encuentre dentro de los límites seguros y adecuados.
- La fórmula de la tensión permite calcular la energía eléctrica que se transmite por un circuito, lo que es esencial para hacer cálculos de costos y presupuestos.
- Permite ajustar la tensión para adaptarla a diferentes necesidades de un circuito, por ejemplo, aumentando o disminuyendo la tensión para ajustar la velocidad de un motor eléctrico.
Desventajas
- No considera la resistencia interna del dispositivo: La fórmula de la tensión supone que la fuente de energía que suministra la tensión es perfecta, es decir, que no tiene resistencia interna. Sin embargo, en la práctica, todas las fuentes de energía tienen cierta resistencia interna, lo que puede afectar la medición de la tensión real.
- No considera la interferencia: La fórmula de la tensión asume que la medición se realiza en un circuito aislado, sin interferencias de otros dispositivos. Sin embargo, en la práctica, es común que haya otros dispositivos en el circuito que puedan generar interferencias y afectar la medición de la tensión.
- No considera la variación de la tensión con la carga: La fórmula de la tensión se aplica a un circuito abierto, es decir, sin carga. Sin embargo, en la práctica, la tensión puede variar cuando se conecta una carga al circuito, debido a la resistencia de la carga y la caída de tensión que se produce en ella.
- No es aplicable en todos los casos: La fórmula de la tensión se puede aplicar en circuitos eléctricos con corriente continua (CC), pero no es válida en circuitos con corriente alterna (CA). En estos casos, se requieren fórmulas diferentes para calcular la tensión eficaz o la tensión pico a pico.
¿Qué cantidad de fuerza se está ejerciendo sobre la cuerda?
La determinación de la cantidad de fuerza que se está ejerciendo sobre una cuerda es esencial para la producción de notas específicas. Esto se conoce como la tensión de la cuerda o peso, medida en newtons. La vibración de una longitud de cuerda determinada, también conocido como vibrating string length, es la base para reproducir la nota deseada y su medida precisa es vital para obtener una afinación precisa en un instrumento musical.
La medición de la tensión de una cuerda es crucial para lograr notas específicas en la producción musical. La longitud de vibración de la cuerda es fundamental para la afinación precisa y la reproducción de la nota correcta. La precisión en estas mediciones es esencial para garantizar un sonido armónico en un instrumento musical.
¿Cuál es el método para calcular el peso y la tensión?
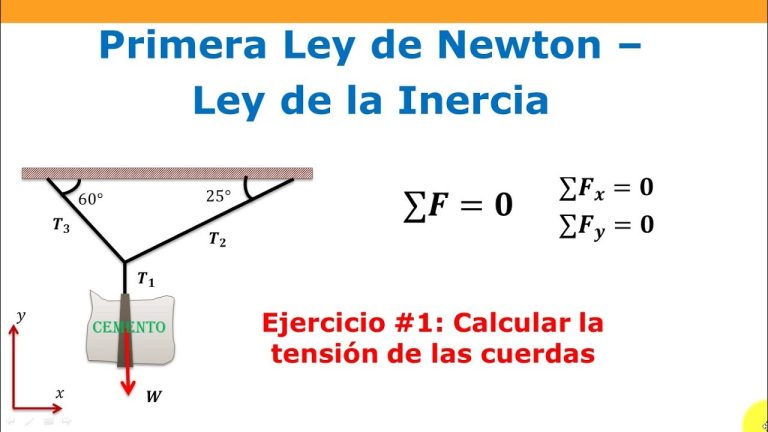
El método para calcular el peso y la tensión en un sistema de cuerda es a través de la ecuación masa x aceleración = tensión – peso. Esta fórmula ayuda a determinar cuánta tensión debe soportar una cuerda para mantener una masa suspendida en reposo, así como la fuerza neta necesaria para acelerarla. Al conocer el peso de la masa y la aceleración, es posible calcular la tensión requerida y asegurar que la cuerda tenga la resistencia adecuada para soportarla.
La ecuación de masa x aceleración = tensión – peso es esencial para el cálculo de la tensión requerida en un sistema de cuerda. Conociendo la masa y la aceleración de un objeto en reposo, esta fórmula permite calcular la resistencia necesaria de la cuerda para soportarlo adecuadamente. Es una herramienta útil para garantizar la seguridad en trabajos donde se utilizan cuerdas, cables y poleas.
¿Qué es la definición de la fuerza de tensión?
La fuerza de tensión es una fuerza de estiramiento que se aplica a través de un objeto sólido, como un cable, cuerda o cadena. Su origen surge de una acción externa y siempre actúa en la dirección opuesta a la fuerza aplicada. Es común encontrar esta fuerza en la física elemental y se utiliza para describir el comportamiento de objetos en movimiento y estáticos.
La fuerza de tensión es una fuerza de estiramiento que se manifiesta en objetos sólidos como cuerdas y cables. Se origina por una acción externa y actúa en sentido contrario a la fuerza aplicada, y es utilizada en la física elemental para describir objetos en movimiento y en reposo.
Desmitificando la Formula de la Tensión: Entendiendo los Principios Básicos
La fórmula de la tensión eléctrica es uno de los conceptos fundamentales en la electricidad, y a menudo se considera un concepto difícil de entender. Sin embargo, su entendimiento es clave para el planteamiento de cualquier problema eléctrico y para el diseño de circuitos eléctricos. Los principios básicos que subyacen a la fórmula de la tensión incluyen los conceptos de carga, voltaje y resistencia eléctrica, y su relación matemática es simple. Desmitificar la fórmula de la tensión es crucial para comprender la electricidad y aplicarla en problemas cotidianos.
Comprender la fórmula de la tensión eléctrica es esencial para abordar problemas eléctricos y diseñar circuitos eficientes. Esta fórmula se basa en la relación entre carga, voltaje y resistencia eléctrica, y es clave para entender los conceptos básicos de la electricidad. Al desmitificar este concepto, se puede aplicar la electricidad de manera más efectiva y resolver problemas cotidianos de manera más eficiente.
La Fórmula de la Tensión: Su Aplicación en la Ingeniería y la Física
La fórmula de la tensión es una de las más utilizadas en la ingeniería y la física para calcular la fuerza que actúa sobre un objeto. Esta fórmula se define como la fuerza que actúa sobre una determinada área, y su unidad de medida es el pascal (Pa). Es esencial conocer la tensión en diferentes estructuras y materiales, ya que esto ayuda a determinar si son seguros y resistentes en situaciones de carga máxima. Su aplicación se extiende desde la ingeniería civil hasta la elaboración de materiales y objetos para la industria automotriz y aeroespacial.
La fórmula de la tensión es fundamental en la ingeniería y física para calcular la fuerza que actúa en un objeto. Su aplicación es amplia en diversas áreas desde la construcción hasta la industria automotriz y aeroespacial, lo que muestra su importancia en el diseño y evaluación de estructuras y materiales.
La fórmula de la tensión es una herramienta esencial en la física y la ingeniería para analizar y entender los sistemas que se basan en cargas eléctricas. Esta fórmula permite calcular la cantidad de energía eléctrica necesaria para mover una carga desde la fuente de energía hacia el punto de destino. Además, con esta fórmula también se puede predecir el comportamiento de los conductores eléctricos y sus limitaciones. Con un conocimiento adecuado de la fórmula de la tensión, es posible diseñar sistemas eléctricos eficientes y evaluar su rendimiento en diferentes situaciones. Por lo tanto, es crucial que los ingenieros y técnicos comprendan la fórmula de la tensión y su aplicación práctica para aprovechar al máximo su utilidad.